
Por volta de 400 anos a.C. filósofo grego Demócrito sugeriu que a matéria não é contínua, isto é, ela é feita de minúsculas partículas indivisíveis. Essas partículas foram chamadas de átomos (a palavra átomo significa, em grego, indivisível).
Demócrito postulou que todas as variedades de matéria resultam da combinação de átomos de quatro elementos: terra, ar, fogo e água.
Demócrito baseou seu modelo na intuição e na lógica. No entanto foi rejeitado por um dos maiores lógicos de todos os tempos, o filosofo Aristóteles. Este reviveu e fortaleceu o modelo de matéria contínua, ou seja, a matéria como "um inteiro".
Os argumentos de Aristóteles permaneceram até a Renascença.
MODELO DE DALTON

Todo modelo não deve ser somente lógico, mas também consistente com a experiência. No século XVII, experiências demonstraram que o comportamento das substâncias era inconsistente com a idéia de matéria contínua e o modelo de Aristóteles desmoronou.
Em 1808, John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. Dalton acreditou que o átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu assim o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
Fonte: educar.sc.usp.br
MODELOS ATÔMICOS
MODELO DE THOMSON

Em 1987, o físico inglês J.J. Thomson demonstrou que os raios catódicos poderiam ser interpretados como um feixe de partículas carregadas que foram chamadas de elétrons. A atribuição de carga negativa aos elétrons foi arbitrária.
Thomson concluiu que o elétron deveria ser um componente de toda matéria, pois observou que a relação q/m para os raios catódicos tinha o mesmo valor, qualquer que fosse o gás colocado na ampola de vidro.
Em 1989, Thomson apresentou o seu modelo atômico: uma esfera de carga positiva na qual os elétrons, de carga negativa, estão distribuídos mais ou menos uniformemente. A carga positiva está distribuída, homogeneamente, por toda a esfera.
Modelo nuclear (Rutherford)

Em 1911, Lord Rutherford e colaboradores (Geiger e Marsden) bombardearam uma lâmina metálica delgada com um feixe de partículas alfa atravessava a lâmina metálica sem sofrer desvio na sua trajetória (para cada 10.000 partículas alfa que atravessam sem desviar, uma era desviada).
Para explicar a experiência, Rutherford concluiu que o átomo não era uma bolinha maciça. Admitiu uma parte central positiva muito pequena mas de grande massa ("o núcleo") e uma parte envolvente negativa e relativamente enorme ("a eletrosfera ou coroa"). Se o átomo tivesse o tamanho do Estádio do Morumbi, o núcleo seria o tamanho de uma azeitona.
Surgiu assim o modelo nuclear do átomo.

O modelo de Rutherford é o modelo planetário do átomo, no qual os elétrons descrevem um movimento circular ao redor do núcleo, assim como os planetas se movem ao redor do sol.
Modelo de Bohr


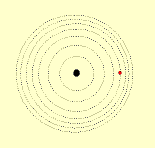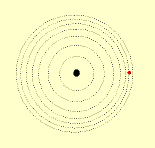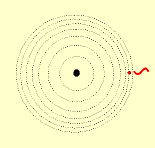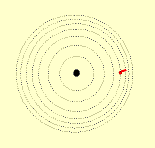
O modelo planetário de Rutherford apresenta duas falhas:
Uma carga negativa, colocada em movimento ao redor de uma carga positiva estacionária, adquire movimento espiralado em sua direção acabando por colidir com ela.
Essa carga em movimento perde energia, emitindo radiação. Ora, o átomo no seu estado normal não emite radiação.
Em 1913, o físico dinamarquês Niels Bohr expôs uma idéia que modificou o modelo planetário do átomo.
Um elétron num átomo só pode ter certas energias específicas, e cada uma destas energias corresponde a uma órbita particular. Quanto maior a energia do elétron, mais afastada do núcleo se localiza a sua órbita.
Se o elétron receber energia ele pula para uma órbita mais afastada do núcleo. Por irradiação de energia, o elétron pode cair numa órbita mais próxima do núcleo. No entanto, o elétron não pode cair abaixo de sua órbita normal estável.
Mais tarde, Sommerfeld postulou a existência de órbitas não só circulares mas elípticas também.
Modelo orbital
Sabe-se hoje que é impossível determinar a órbita (trajetória) de um elétron. Pode-se determinar a probabilidade relativa de encontrar o elétron numa certa região ao redor do núcleo.
Imaginando uma pessoa munida de uma lanterna em um quarto escuro. Essa pessoa move-se ao acaso pelo quarto e de tempo em tempo ela acende e apaga a lanterna. Em um papel milimetrado vamos marcar a posição da pessoa. Quando a lanterna acende sabe-se onde a pessoa estava, mas não onde está agora. O papel milimetrado ficaria com o aspecto dado na figura ao lado.
Em outras palavras, é impossível determinar a trajetória de um elétron num átomo.
Surge então o modelo orbital.
Orbital é a região de máxima probabilidade de encontrar o elétron.
Orbital é a região onde o elétron gasta a maior parte do seu tempo.
Teoria dos Quarks
A teoria mais moderna afirma que existe apenas 12 partículas elementares: seis chamadas léptons (o elétron faz parte deste grupo) e outras seis chamadas quarks.
Dois tipos de quarks, o up (para cima) e o down (para baixo), formam os prótons e os nêutrons.
O quark up tem carga +2/3 enquanto o down tem carga -1/3. O próton é um agregado de dois up e um down enquanto o nêutron é constituído por um up e dois down.
Dois outros quarks foram batizados de charm (charme) e strange (estranho). O charm tem carga +2/3 enquanto o strange tem carga -1/3. Existem nos raios cósmicos.
Em 1997, foi descoberto o quinto quark, o bottom, enquanto o sexto e último quark, o top, foi identificado em 1995.
O top tem carga -2/3 e o bottom, -1/3.
O top é o mais pesado dos quarks (200 vezes mais pesado que um próton) e não está presente nem em fenômenos normais da natureza nem em raios cósmicos, devido à alta energia exigida para sua formação. O top deve ter sido produzido no início do universo e depois pode ter desaparecido.
Fonte: www.algosobre.com.br



o modelo de Bohr
ResponderExcluiré o mesmo modelo de dalton ?