01. Qual o número de tipos de moléculas diferentes em um grande reservatório de gás cloro?
Dados: a) o gás cloro tem forma molecular Cl2, isto é, ele tem dois átomos de cloro por molécula;
b) o cloro apresenta dois isótopos naturais: Cl35 e Cl37.
![]()
a) 26 átomos de ferro de número de massa 56.
b) 26 átomos grama de ferro de número de massa 56.
c) Um isóbaro de ferro de número de massa 56.
d) Um isótono de ferro de número de massa 56.
e) Isótopo de ferro de número de massa 56.
03. Um átomo de número atômico Z e número de massa A:
a) tem A nêutrons.
b) tem A elétrons.
c) tem Z prótons.
d) tem A – Z nêutrons.
04. (STA. CASA) A questão deve ser respondida de acordo com o seguinte código:
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.
A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
05. (FUVEST) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
06. (FUVEST) A seguinte representação ![]() , X = símbolo do elemento químico, refere-se a átomos com:
, X = símbolo do elemento químico, refere-se a átomos com:
a) Igual número de nêutrons;
b) Igual número de prótons;
c) Diferentes números de elétrons;
d) Diferentes números de atômicos;
e) Diferentes números de oxidação;
07. (MACK) Indique a alternativa que completa corretamente as lacunas do seguinte período: “Um elemento químico é representado pelo seu ___________ , é identificado pelo número de __________ e pode apresentar diferente número de __________ .”
a) nome – prótons – nêutrons.
b) nome – elétrons – nêutrons.
c) símbolo – elétrons – nêutrons.
d) símbolo – prótons – nêutrons.
e) símbolo – – elétrons – nêutrons.
08. (PUC) Quando um metal cristaliza no sistema cúbico de faces centradas, seu número de coordenação, isto é, o número de átomos que envolve cada átomo, será igual a:
a) 3
b) 4
c) 6
d) 8
e) 12
09. (CESCEM) As estruturas cristalinas dos metais A e B são do tipo hexagonal. Essas estruturas devem ter iguais:
a) Densidades.
b) Números de coordenação.
c) Condutibilidades elétricas.
d) Propriedades químicas.
e) Números de átomos por volume unitário.
10. (ENG. SANTOS) As grandes cristalinas das três substâncias sulfato de potássio (K2SO4), enxofre (S) e zinco (Zn) apresentam respectivamente em seus nós:
a) Íons, moléculas e átomos.
b) Íons, átomos e moléculas.
c) Moléculas, átomos e íons.
d) Átomos, moléculas e íons.
e) n.d.a.
11. (ABC) O deutério é um:
a) Isóbaro de hidrogênio.
b) Isótopo de hidrogênio.
c) Radioisótono do hidrogênio.
d) Isômero do hidrogênio.
e) Alótropo do hidrogênio.
12. (ITA) São definidas quatro espécies de átomos neutros em termos de partículas nucleares:
Átomo I – possui 18 prótons e 21 nêutrons
Átomo II – possui 19 prótons e 20 nêutrons
Átomo III – possui 20 prótons e 19 nêutrons
Átomo IV – possui 20 prótons e 20 nêutrons
Pode-se concluir que:
a) os átomos III e IV são isóbaros;
b) os átomos II e III são isoeletrônicos;
c) os átomos II e IV são isótopos;
d) os átomos I e II pertencem ao mesmo período da Classificação Periódica;
e) os átomos II e III possuem o mesmo número de massa.
13. (MACK) Assinale a alternativa incorreta:
![]()
b) Isótopos são átomos de diferentes números atômicos e iguais número de nêutrons.
![]()
d) Isótonos são átomos de elementos diferentes e iguais número de nêutrons.
e) n.d.a.
14. (PUC-RIO) Os isótopos ![]() possuem respectivamente os seguintes números de nêutrons:
possuem respectivamente os seguintes números de nêutrons:
a) 8, 8, 8
b) 8, 9, 10
c) 16, 17, 18
d) 24, 25, 26
e) 18, 17, 16
15. (PUC – RIO) Os fenômenos isotopia, isobaria e alotropia são representados respectivamente pelos exemplos:
ISÓTOPOS ISÓBAROS ALÓTROPOS
a) O2; O3 ![]()
![]()
b) ![]()
![]() O2; O3
O2; O3
c) O2; O3 ![]()
![]()
d) ![]() O2; O3
O2; O3 ![]()
e) ![]()
![]() O2; O3
O2; O3
16. Têm-se os seguintes átomos e íons genéricos:
![]()
São, respectivamente, isoeletrônicos, isótopos, isóbaros, isótonos e pertencem ao mesmo elemento químico os seguintes pares:
a) B1+ e E2+ / A e D / C e F / B e E / A e D
b) B1+ + E2+ / C e F / A e D / C e B / B e D
c) A1+ + F / B e C / C e E / B e D / A e D
d) A1+ e E2+ / A e D / C e F / B e E / A e D
e) C e F / A e D / B e E / A e F / B e C
17. (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
18. (ABC) De acordo com e regra de Hund, estrutura eletrônica do átomo de carbono, no estado fundamental, é representada por:
a) 1s2 2s2 3p2
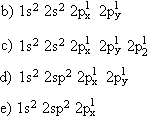
19. Conceitue orbital de um elétron.
20. Indique a distribuição eletrônica do oxigênio (Z = 8) no estado fundamental.
21. (ITA) O número máximo de orbitais atômicos correspondente ao número quântico principal é:
a) n
b) 2n
c) 2n + 1
d) n2
e) 2n2
22. (CESCEM) Qual dos valores abaixo pode representar o número atômico de um átomo que, no estado fundamental, apresenta apenas dois elétrons de valência?
a) 16
b) 17
c) 18
d) 19
e) 20
23. (FUVEST) Em um átomo, quantos elétrons podem ocupar o orbital p representado na figura?
a) 2
b) 3
c) 4
d) 5
e) 6
24. (PUC) O número normal de subníveis existentes no quarto nível energético dos átomos é igual a:
a) 1
b) 2
c) 3
d) 4
e) 5
25. (OSEC) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. o número total de elétrons desse átomo é igual a 19;
II. esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a firmação I é correta.
b) Apenas a firmação II é correta.
c) Apenas a firmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações II e III são corretas.


Queria as respostas! O site está ÓTIMO, muito bom mesmo. mas já procurei as respostas desse assunto e desses exercícios e não acho.
ResponderExcluiridem
ResponderExcluircade a porrr%$# da resposta ?
ResponderExcluirPelo que eu vi as respostas estão aqui no gabarito http://prevestibularonline.blogspot.com.br/2008/05/gabarito-pre-vestibular-online-nivel-2.html, na parte de quimica.. Espero que tenha ajudado!!
ResponderExcluir