Na água, os compostos iônicos sofrem dissociação, e os moleculares sofrem ionização
Se colocarmos cloreto de sódio, o sal de cozinha (NaCl), em um recipiente contendo água, o que ocorrerá é que os íons já existentes no retículo cristalino do sal serão separados. Os íons já existiam antes porque o cloreto de sódio é formado por meio de uma ligação iônica entre o sódio (Na) que doa um elétron para o Cloro (Cl), formando os íons Na+ e Cl-.
.jpg)
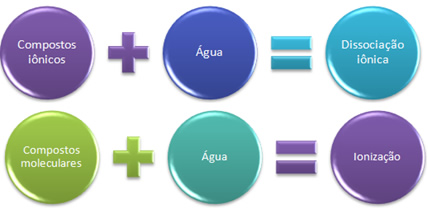
Nesse caso, temos uma dissociação iônica, também denominada dissociação eletrolítica. Portanto,dissociação iônica é quando íons que já existiam antes são separados, ou seja, só ocorre com compostos iônicos.
Agora, coloca-se na água um composto formado por apenas ligações covalentes, um composto molecular; é o caso, por exemplo, do ácido clorídrico (HCl). Nesse composto não existem íons, pois a ligação covalente se dá por compartilhamento de elétrons.
Porém, ao se solubilizar na água, ocorre a quebra das moléculas de HCl, em que o par de elétrons compartilhado fica com o cloro, que é mais eletronegativo, formando, então, os íons H+ e Cl-.
.jpg)
Quando temos uma reação química em que há a formação de íons, como essa citada, dizemos que ocorreu uma ionização.
Resumidamente temos:


0 Response to "Diferença entre Dissociação Iônica e Ionização"
Postar um comentário