Gases:
1. Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosféras?
Lembrando que existe uma relação entre estas grandezas expressa por:
![]()
Podemos isolar a grandeza que desejamos calcular, ou seja, a velocidade:
![]()
Convertendo os dados do problema para grandezas do SI:
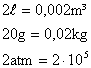
Utilzando os dados na equação:
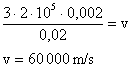
2. Em um tubo com pressão constante de 1atm ocorre uma transformação. Sendo a temperatura inicial igual a 20°C e a final igual a 0°C, de quantas vezes o volume foi modificado?
Como pressão não pode ser diferente da pressão atmosférica, então a transformação é Isobárica, sendo regida por:
![]()
Neste caso, não é necessário converter as unidades para o SI, pois ambas têm mesma característica:
![]()
Lembrando que é necessário que as temperaturas estejam em escala absoluta:
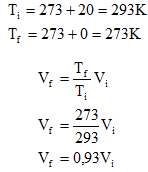
3. Qual a energia cinética média das moléculas de 10 mols de um gás perfeito, na temperatura de 100°C? E na temperatura de 100K? Considere R=8,31 J/mol.K
Sabemos que a energia cinética média das moléculas de um gás é dado por:
![]()
No entanto a temperatura utilizada é a absoluta, por isso deve ser convertida, para o primeiro caso:
![]()
Aplicando estes valores na equação:
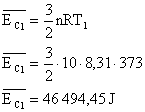
Para o segundo caso (T=100K):
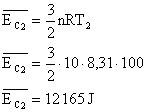
Transformações:
1. Um gás sofre uma expansão sob temperatura constante, o volume ocupado inicialmente pelo gás era 0,5 litros, e no final do processo passou a ser 1,5 litros. Sabendo que a pressão inicial sob o gás era o normal no ambiente, ou seja, 1 atm, qual a pressão final sob o gás?
Como a temperatura não é modificada durante a transformação, esta é Isotérmica, sendo regida pela equação:
![]()
Neste caso não é necessário converter as unidades para o SI pois ambas têm mesma característica, ou seja volume é expresso em litros e pressão em atm, portanto, a pressão final será dada em atm:
![]()
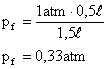
2. Em um tubo aberto ocorre uma grande compressão em um gás que torno o volume ocupado por ele 10 vezes menor. Sendo a temperatura inicial igual a 20°C, qual será a temperatura final?
Como o tubo é aberto, a pressão não pode ser diferente da pressão atmosférica, então a transformação é Isobérica, sendo regida por:
![]()
Neste caso não é necessário converter as unidades para o SI pois ambas têm mesma característica:
![]()
Mas o volume inicial é igual a 10 vezes o volume final:
![]()
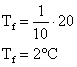
3. Um botijão de gás não pode variar o volume do gás que se encontra em seu interior. Se este for tirado de um ambiente arejado, onde a pressão interna é 3 atm e a temperatura 15°C, e é posto sob o Sol, onde a temperatura é 35°C. Supondo que o gás seja ideal, qual será a pressão após a transformação?
Como o volume não varia durante a transformação, esta é Isométrica, sendo regida por:
![]()
Mas as temperaturas devem ser medidas em escala absoluta, ou seja:
![]()
Isolando-se a pressão final:
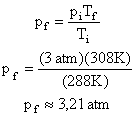
4. Um gás perfeito à temperatura de 0°C e sob pressão de uma atmosfera ocupa um volume igual a 22,4 litros. Qual seria o volume ocupado por 5 mols deste gás a 100°C, sob a pressão de 1 atm?
Utilizando a Equação de Clapeyron para ambas situações podemos chegar a um sistema de equações:
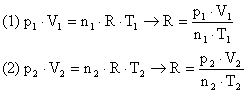
Igualando as equações:
![]()
A temperatura deve ser passada para escala absoltura para que não haja indeterminações nos cálculos:
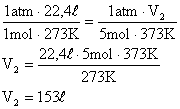


0 Response to "Exercícios Resolvidos Estudo dos Gases"
Postar um comentário