a) Iônica
b) Covalente
c) Dativa
d) Metálica
e) Van der Waals
02. (CESGRANRIO) Identifique, entre os compostos mencionados abaixo, o composto iônico:
a) BCl3
b) Icl
c) CsCl
d) HCl
e) Cl2
03. (U.F. VIÇOSA) A afirmativa falsa, referente à eletronegatividade, é:
a) A diferença entre as eletronegatividades de dois elementos determina a predominância do caráter iônico ou de covalência das ligações entre seus átomos.
b) A eletronegatividade dos elementos de um mesmo grupo de classificação periódica varia diretamente em seus raios atômicos.
c) A eletronegatividade dos elementos de um mesmo período da classificação periódica varia diretamente com carga nuclear.
d) O flúor é o elemento mais eletronegativo dos halogênios.
e) Os elementos de menor eletronegatividade são os metais alcalinos.
04. (FUVEST) Considere as substâncias:
I. argônio
II. diamante
III. cloreto de sódio
IV. água
Dentre elas, apresentam ligações covalentes apenas:
a) I e II
b) I e III
c) II e III
d) II e IV
e) III e IV
05. (PUC) A diferença entre a ligação covalente comum e a ligação covalente dativa ou coordenada reside fundamentalmente na:
a) Diferença de eletronegatividade dos átomos nela envolvidos;
b) Na origem dos elétrons que formam a ligação;
c) No comprimento da reação;
d) Na energia da ligação;
e) No tamanho dos átomos envolvidos;
06. (FUVEST) Na tabela periódica, os elementos químicos estão ordenados:
a) Segundo seus volumes atômicos crescentes e pontos de fusão decrescentes;
b) Rigorosamente segundo suas massas atômicas crescentes e, salvo algumas exceções, também segundo seus raios atômicos crescentes;
c) De maneira tal que os ocupantes de uma mesma família têm o mesmo número de níveis de energia;
d) De tal modo que todos os elementos de transição se localizam no mesmo período;
e) De maneira tal que o volume atômico, ponto de fusão e energia de ionização variam periodicamente.
07. (FUVEST) O número de elétrons do cátion X2+ de um elemento X é igual ao número de elétrons do átomo neutro de um gás nobre. Esse átomo de gás nobre apresenta número atômico 10 e número de massa 20. O número atômico do elemento X é:
a) 8
b) 10
c) 12
d) 18
e) 20
08. (ABC) Pertencem à família dos calcogênios:
a) O cloro e o bromo.
b) O oxigênio e o nitrogênio.
c) O selênio e o telúrio.
d) O sódio e o potássio.
e) O cálcio e o bário.
09. (CEUB) Examine atentamente o gráfico que mostra a variação de determinada propriedade X com o número atômico Z.
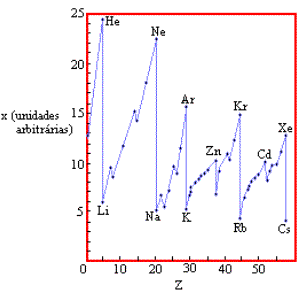
a) A propriedade X é uma propriedade periódica.
b) O valor de X aumenta proporcionalmente com Z.
c) X é uma propriedade aperiódica.
d) Através da análise do gráfico nada se pode dizer quanto à periodicidade de X.
10. (UFAL – UFRN) Se fosse preparado um gás nobre artificial, que na tabela periódica se localizasse logo do Rn (Z = 86), seu número atômico seria:
a) 87
b) 118
c) 140
d) 174
e) 223
11. (CATANDUVA) Qual das partículas abaixo possui maior raio?
Números atômicos: Cl (17); K (19); Ca (20); S (16), Ar (18)
a) Cl-
b) K+
c) Ca2+
d) S2-
e) Ar


0 Response to "Exercícios Tabela Periódica"
Postar um comentário